Atom Nedir?
Mayıs 5, 2021 0
Atom, elementlerin özelliklerini taşıyan en minik yapı birimine atom denir.
Sözcük Yunanca ατομος veya atomostan gelir, ‘bölünemez’ demektir. Eski Yunanistan’da bazı düşünürlere göre atom maddenin bölünemez en minik parçasıydı. Örneğin bir demir parçasını dağılmaya başlasak ilk başta ikiye dağıldığımızda elimizde kalan parçalar yine demir parçasıdır. Sonra daha dağılmaya devam etsek elimizdeki parçalar hep bir demir parçası olur, ta ki demiri oluşturan en minik parçaya yani atoma gelene kadar. Birden fazla atomun oluşturduğu en minik parçalara da molekül denir. Örneğin su maddesini oluşturan en minik parça moleküldür. Bir su molekülü iki hidrojen atomu ve bir oksijen atomunun birleşmesiyle oluşmuş bir moleküldür.
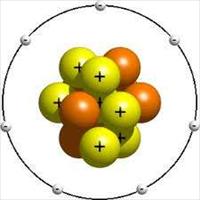
Atomun temel parçacıkları proton, nötron ve elektron’lardır. Protonlar pozitif+ yüklü olarak, elektronlar negatif- yüklü, nötronlar ise yüksüz olarak kabul edilirler. Proton ve nötronlar birliktece atom çekirdeğini oluştururlar; bu parçacıklara nükleon da denir. Elektronlar ise atomun çevresinde bulunurlar ve elektronlar hem kendi eksenleri etrafında hem de atomun çekirdeğinin etrafında çekirdeğe belli uzaklıktaki bir yörüngede dönerler.
Aynı elementin atomları aynı sayıda protona sahiptirler, bu sayıya atom numarası denir. Buna karşın, aynı elementin atomları değişik nötron sayılarına sahip olabilir, bu sayılar o elementin izotoplarını belirler. Proton ve nötronlara kıyasla elektronlar atoma daha cılız eforlarla bağlı olduklarından elektron sayısı basitlikle değişebilir. Çekirdekteki proton ve nötron sayısı da nükleer fisyon, nükleer füzyon ve radyoaktif bozunma yoluyla değişebilir, bu vaziyette atom başka bir elemente dönüşebilir.
Bir atomun çekirdeğindeki proton sayısı ile nötron sayısının toplamı kütle numarasını verir.
Kütle No= Proton Sayısı + Nötron Sayısı
Atomun çekirdeğinde kaç tane pozitif yük varsa etrafında da o kadar negatif yük olmalı ki atom nötr olsun . Protonlar + yüklü, nötronlar yüksüz ve elektronlar – yüklü tanecikler olduğuna göre nötr atomlarda proton sayısı daima elektron sayısına eşit olmalıdır. Proton sayısı aynı zamanda çekirdek yükünün bir ifadesidir.
Atom No = proton sayısı = elektron sayısınötr atomlarda = çekirdek yükü
Bazen atomlar son yörüngelerindeki elektron sayılarını belli sayıyı bitirmek için elektron alış-verişi yaparlar. Ve bu parçacıklarından yalnızca elektronlarını alıp verebilirler. Normalde hiç elektron almamış ve vermemiş olan bir atomun elektron sayısı proton sayısına eşittir. Atom bu durumdayken bu atoma nötr atom denir. Ancak başka bir atomla elektron alış-verişi yaparsa iyon durumuna geçer. Şayet nötr bir atom elektron veriyorsa proton sayısı elektron sayısından fazla hale gelir ve bu atomlara pozitif iyonkatyon denir. Şayet bütün tersi olup da atom elektron kaybetmek yerine elektron kazanırsa bu sefer de elektron sayısı proton sayısından fazla hale gelir ve bu atomlara da negatif iyonanyon denir.
İzotop Atomlar: Atom numaraları aynı kütle numaraları değişik ya da proton sayıları aynı nötron sayıları değişik olan atomlara bir birinin izotopu atomlar denir. İzotop atomların kimyasal özellikleri aynı olduğu halde fiziksel özellikleri değişiktir.
Allotrop Atomlar : Aynı elementin uzayda değişik şekilde dizilerek değişik geometrik şeklindeki kristallerine allotrop denir. Örneğin grafitle elmas, beyaz fosforla kırmızı fosfor, rombik kükürtle monoklinik kükürt, ozon ile oksijen birbirinin allotropudur. Allotropların fiziksel özellikleri değişik olduğu halde kimyasal özellikleri aynıdır.
İzoton : Nötron sayıları eşit olan atomlara birbirinin izotonu denir.
İzobar: Kütle numaraları aynı atom numaraları değişik olan atomlara izobar atomlar denir.
İzoelektronik: Elektron sayıları bir birine eşit olan atomlardır.
Atom Tarihçe
Atom nedir? “Maddenin en minik yapıtaşı!
“Atom” sözcüğünün ilk ortaya çıkısı I.Ö. 460 yılına kadar uzanıyor. O dönemde yasamış Demokritus adli bir filozof, bir elmayı örnek vererek Atomu ve anlamını açıklamış: Bir elma alin ve onu ikiye bölün. Sonra bu yarim elmalardan birini tekerrür ikiye bölün ve böylece sürdürün… Demokritus’a göre, bu şekilde yarim parçaları dağılmaya devam ederseniz, sonunda öyle bir an gelecek ki, artik bölemeyeceğiniz kadar minik bir parça elde edeceksiniz ama bıçağınız kesemediği için denil, dağılmak mümkün olmadığı için!. İşte, bölünmesi olanaksız bu parçaya Demokritus Yunanca’da ‘bölünemez” anlamına gelen “atomos” adını vermiş.
1800’li senelerin başında Bilim adamları maddenin doğasını anlamaya yönelik çalışmaları sırasında ister istemez bu minik parçacıklarla karsılaşmışlar. İngiliz bilim adamı Dalton, deneyleri sırasında, maddeyi oluşturan ama yapısını tanımlayamadığı bu temel öğelere iliksin ilk kanıtları elde etmiş. Ondan sonra da kesifler arkasını sıra devam etmiş.
Atomun varlığı kanıtlandıktan sonra da, yapısını anlamaya yönelik bir çok teori ortaya atılmış. Bunlardan ilki J. J. Thomson adli bir İngiliz fizikçiden geliyor
Thomson, 1897 yılında Atomun bir parçası olan eksi yüklü elektronları keşfetmiş. Thomson’a göre atomun içinde eksi yüklü elektronları dengeleyecek artı yüklü parçacıklar olması gerekiyordu. Thomson, atomu bir “üzümlü kek”e benzetmişti: Üzümler eksi yüklü elektronlar, kekin diğer kısımları ise artı yüklü madde.
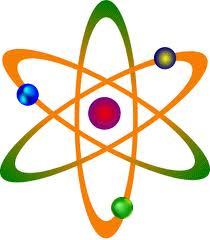
Rutherford’un atom modeli, Günes Sistem’imizin yapısına benziyor. Ortada Güneş, yani artı yüklü çekirdek ve çevresinde dolanan gezegenler, yani eksi yüklü elektronlar. Rutherford’un bu modeline göre çekirdek atomun çok minik bir parçası: Örneğin atomun boyutunu Dünya kadar büyütsek bile içindeki çekirdek en fazla bir futbol stadyumu kadar kalıyordu. Rutherford daha da
önemli bir adim atarak, çekirdek içinde artı yüklü parçacıkları yani protonları keşfetmiş ve protonların elektronlardan 1836 defa daha ağır olduğunu bulmuş. Fakat bu model de bazı teorisal sorunlar çıkarmış. 1912 yılında Danimarkalı fizikçi Niels Bohr, bu teorisal sorunları çözecek bir model oluşturmuş. Bor’un atom modelinde, yine ortada artı yüklü bir çekirdek, fakat sadece belli yörüngelerde dolanabilen eksi yüklü Elektronlar var. Bundan sonraki gelişmeler, Bohr’un atom modelini düzenlemeye yönelik. Bu gelişmelerden biri, çekirdekte artı yüklü proton dışında, yüksüz “nötron” adi verilen parçacıkların da olduğu. Nötronları da 1932 yılında, James Chadwick, kendisinin yaptığı derme çatma bir detektörle keşfetmiş.
ATOM ve YAPISI
Maddelerin gözle görülmeyen bölünmeyen en parçasına atom denir. Atom kendinden başka hiçbir fiziksel ya da kimyasal metotlarla kendinden değişik atomlara dönüşemezler. Atomda + yüklü protonalar,- yüklü elektronlar ve yüksüz nötronlar bulunur. Atom çekirdek ve elektron olmak üzere iki temel parçacıktan oluşur.
Çekirdek: Atomun merkezini oluşturur. Hacim olarak çok minik1/10000 olmasına karşın tüm ağırlığın1/1840 toplandığı kısımdır.
Protonlar: Bir element için proton sayısı sabittir. Elementin tümünü ve tüm özellikleri belirleyen protondur.Proton sayısı değiştiğinde elementin cinsi ve tüm özelliği değişir.”p” harfiyle gösterilir.
Elektron: ”e” harfiyle gösterilir. Çekirdek çevresinde ,belirli yörüngelerde bulunurlar. Elektronlar bağımsız yörüngelerde bulunamazlar.
ATOM MODELLERİ:
DALTON ATOM MODELİ :
19 . Asra gelene kadar bu düşüncelere bir ilave yapılmadı ve İlk defa John Dalton 1766 1844 Atom kavramınını tekerrür ele alarak modern atom kavramını ortaya attı. Dalton kimyasal reaksiyonlarda bütün sayılarla belirlenen oranlarda maddenin tepkimeye girdiğini gösterdi ve maddelerin atom denen sayılabilir ama bölünemez parçalardan yapıldığını ifade etti. Aynı zamanda atomların ağırlıklarını ortaya koyan bir çizelge hazırladı.
1- Madde, atom denilen içleri dolu bölünemeyen taneciklerden oluşmuştur.
2- Aynı elementin atomları büyüklük yönünden birbirinin aynı, değişik elementlerin atomları tamamen birbirinden değişiktir.
3- Tepkimelerde atomlar korunur.
4- Atomların birleşmeleri sonunda moleküller oluşur.
THOMSON ATOM MODELi :
J.J.Thomson 1897 yılında elektronu keşfetti. 1900’lü senelerin başlarında Ernest Rutherfort1871 1937 günümüz atom modelinin temelini teşkil eden esas yapıyı ortaya koydu. Atom’un; kütlesinin büyük bir kısmını olusturan çekirdek ve bu çekirdek etrafında dönen elektronlardan yapıldığını ortaya koydu.
Thomson, maddenin düzgün olarak dağıtılmış pozitif yükler ve aralarına serpiştirilmiş negatif yüklerden oluştuğunu ifade etmiştir. Bu yönüyle madde atomu üzümlü keke benzetilebilir. Kek pozitif yük, üzümler ise elektronlardır.
RUTHERFORD ATOM MODELi :
Rutherfort çekirdeği oluşturan pozitif yüklü parçaya “proton” adını verdi.
Merkezde kütlesi çok büyük bir çekirdek ve etrafında belirli yörüngelerde dolanan elektronlardan oluşmuştur. Bu fikrin yetersizliği ise; Elektronun neden çekirdeğe düşmediği yada atomdan fırlayıp gitmediği sorusunun cevapsız kalmasıdır.
BOHR ATOM MODELi :
1932 yılında Chadwick nötronu buldu. Daha sonra Kuantum teorisi doğrultusunda Niels Bohr1883 1962 Bohr atom modelini ortaya attı ve elektronların belli yörüngelerde bulunabildiğini ve bunun plank sabiti ile ilgili olduğunu ifade etti.
Bohr atom modeli, elektronların çekirdekten herhangi bir uzaklıkta bulunan tek bir yörüngede değil, belirli yörüngede olduğunu belirtir. Bir elektronun bulunduğu yer elektronun sahip olduğu enerjiye bağlıdır. Bu enerji seviyeleri çekirdeğe yakın olandan uzağa doğru 1,2,3…. gibi numaralar verilerek gösterilir. Enerji seviyelerinin enerjisi çekirdeğe yanaştıkça eksilir, uzaklaştıkça çoğalır. Elektron bir üst enerji seviyesine enerji verilerek uyarılır ve enerji kesilirse elektron eski yerine gelir ve bu arada aldığı enerjiyi ışık şeklinde yayar.
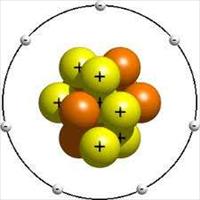
 MODERN ATOM MODELİ
MODERN ATOM MODELİModern atom modeli, dalga mekaniğindeki gelişmelerin elektronun hareketine uygulanmasına dayanmaktadır. 1920’li senelerde Werner Heisenberg, atomlardan minik taneciklerin davranışlarını belirlemek için ışığın etkisini inceledi ve modern atom modeli nin temlerini attı.
1. Elektronlar çekirdek çevresinde belirli enerji seviyelerinde bulunur. Her enerji seviyei n ile belirtilir. Bu enerji seviyelerine baş kuant sayısı denir. Baş kuant sayısı orbitallerin çekirdekten vasati uzaklığını ya da enerjisini belirler. Çekirdekten uzaklaştıkça enerji çoğalır. Çünkü protonların elektronları çekim eforu eksilir, buna bağlı olarak da elektronların hareketi ve enerjisi çoğalır.
2. Elektronlar hem kendi çevrelerinde hem de çekirdek çevresinde döner. Elektronun kendi ekseni etrafında dönme hareketine spin hareketi, çekirdek çevresindeki dönme hareketine de orbital hareketi denir. Çekirdek çevresinde dönmeleri sırasında elektronların bulunma ihtimalinin yüksek olduğu geometrik bölgelere orbital denir. Dört çeşit orbital vardır.
s orbitali: Küresel bir şekle sahiptir. Birinci enerji seviyeinden itibaren her enerji seviyeinde bir tane s orbitali bulunur. En çok iki elektron alır.
p orbitali: İkinci enerji seviyeinden itibaren her enerji seviyeinde vardır. p orbitalleri, px , py ve pz olmak üzere üç çeşittir. Aynı enerji seviyeinde bulunan üç orbitalin de enerjileri birbirine eşittir.en çok altı elektron alır.
d orbitali: Üçüncü enerji seviyeinden itibaren her enerji seviyeinde vardır. Beş çeşit d orbitali vardır. Aynı enerji seviyeindeki beş orbitalin enerjileri birbirine eşittir. En çok on elektron alır.
f orbitali: Dördüncü enerji seviyeinden itibaren her enerji seviyeinde enerjileri birbirine eşit yedi tane f orbitali vardır. En çok on dört elektron alır.
Etiketler : Atom Bilim
Tags: Atom Nedir?, Güncel Teknoloji Haberleri, Teknoloji
Categories: Teknoloji

 MODERN ATOM MODELİModern atom modeli, dalga mekaniğindeki gelişmelerin elektronun hareketine uygulanmasına dayanmaktadır. 1920’li senelerde Werner Heisenberg, atomlardan minik taneciklerin davranışlarını belirlemek için ışığın etkisini inceledi ve modern atom modeli nin temlerini attı.
MODERN ATOM MODELİModern atom modeli, dalga mekaniğindeki gelişmelerin elektronun hareketine uygulanmasına dayanmaktadır. 1920’li senelerde Werner Heisenberg, atomlardan minik taneciklerin davranışlarını belirlemek için ışığın etkisini inceledi ve modern atom modeli nin temlerini attı.